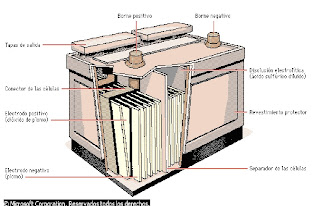
a) Un ánodo formado por una serie de placas de plomo.
b) Un cátodo constituido por una serie de placas de plomo recubiertas de PbO2.
c) Un líquido electrolítico que es una disolución de ácido sulfúrico donde se hayan sumergidos lo electrodos.
Las reacciones que se producen en el acumulador de plomo son las siguientes:
Oxidación (ánodo):
Pb + HSO4- -------->H+ + 2e- Eº = 0,295 V
Reducción (cátodo):
PbO2 + HSO4- + 3H+ + 2e- ------->PbSO4 + 2H2O Eº= 1,625 V
Reacción Global:
Pb + PbO2 + 2H+ + 2HSO4- <_-_-_-_-_-_-_> 2PbSO4 + 2H2O Eº= 1,920 V
Las reacciones anteriores son todas ellas reversibles. De izquierda a derecha son de descarga y en ellas se producen consumo de ácido sulfúrico y formación de PbSO4. Por este motivo disminuye la densidad del ácido sulfúrico y, por tanto, midiendo ésta se puede saber si el acumulador está cargado o no lo está. Para cargar el acumulador se aplica a los electrodos una diferencia de potencial superior a la descarga, regenerándose los electrodos y el ácido sulfúrico, volviendo a ser útil. La cantidad de electricidad que puede suministrar un acumulador en la descarga recibe el nombre de capacidad de un acumulador. Tal como se acaba de indicar, con un acumulador se obtiene 2 voltios.
Una de las principales aplicaciones de los acumuladores la constituye la industria automovilística. En los automóviles la corriente de carga la suministra la dinamo. El principal inconveniente que presenta el acumulador de plomo es su elevado peso. Por este motivo se intenta sustituir por otros acumuladores más ligero como los de hierro-níquel y níquel-cadmio.
El acumulador de hierro-níquel está constituido por un ánodo que es una parrilla de acero al níquel recubierta de hierro finamente dividido y por un cátodo que es la misma parrilla, pero recubierta de óxido e hidróxido de níquel. Como líquido electrolítico se utiliza una disolución de hidróxido de potasio.
El acumulador de níquel-cadmio es todavía más ligero. El hierro se ha sustituido por el cadmio, que tiene mayor duración, aunque su costo es más elevado. Como líquido electrolítico se emplea un medio alcalino y como electrodos se utiliza un ánodo de cadmio y un cátodo de níquel. Otra ventaja de este acumulador respecto del acumulador de plomo es que su fuerza electromotriz permanece constante con el uso, a causa de que los iones OH- son eliminados en el transcurso de la reacción.
1 comentario:
gracias ta muy buena la informacion
me salvaste en el trabajo XD
Publicar un comentario